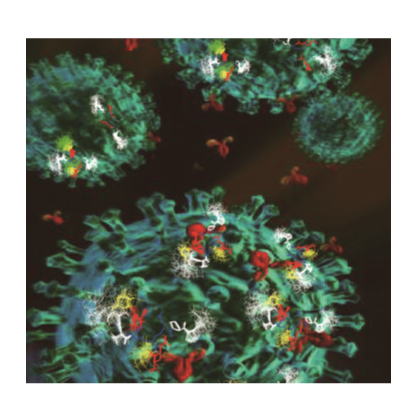
動的エピトープ理論と独創的糖鎖工学に基づく合理的な創薬システムの構築
Rational drug discovery based on a theory of dynamic epitope
and innovative glycotechnology platform |
| 遺伝情報の翻訳後修飾の謎を化学のメスで解剖すれば新たな視点で生命を俯瞰できる |
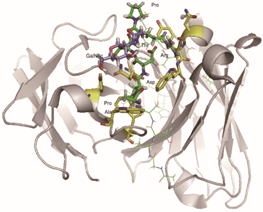 |
私達は「遺伝情報が翻訳後修飾される際の分子機構やその生物学的意義」を解明で「タンパク質の抗原構造が疾患特異的に、しかもダイナミックに変化している」ことを発見しました。例えば、癌と間質性肺炎の患者のある同一のタンパク質の糖鎖構造の違いにより抗原ペプチド領域の立体構造が大きく変化します。この発見が契機となり、静的な抗原性が動的な翻訳後修飾により変貌することを意味する新概念「動的エピトープ理論」を提案しました。この様な疾患特異的な動的エピトープを攻撃する抗体医薬品の研究開発を堅牢な産学連携により推進しています |
| Toward personalized medicine, our goal is to establish a promising strategy
for the rational drug discovery system from disease-relevant “dynamic epitopes”
based on the specific posttranslational modification of the key glycoproteins.
Our new glycotechnology platform, notably glycoblotting-based high throughput
glycomics and microarray displaying robust synthetic glycopeptides library,
allowed for the development of epitope-defined antibodies showing potent
anti-cancer activities. |
ナノソーム:革新的スマートナノ分子シャトルによる癌細胞空間への薬剤送還
Nanosome:Targeting endocytic trafficking of cancer cells by smart nanomedicine platform |
 |
試験管内や培養細胞系で有効とされる医薬品候補のほとんどは臨床試験の最終段階でドロップアウトしています。一方、既存のDDS技術のみでは多様な薬剤の機能を大幅に向上させることは極めて困難です。私達が開発したナノサイズの細胞モデル「ナノソーム」は薬剤を効率良く目的の組織・細胞内空間あるいは特定のオルガネラに運搬して効果的に機能させる普遍的で汎用性に富む革新的な方法論として期待されています |
| Despite emerging potentials of nanoparticles for in vivo medical applications,
the clinical translation of nanomedicines has been limited due to its low
delivery efficiency to the targeted solid tumours. We demonstrated that
small nano-sized hard-core particles coated by cell membrane-mimic monolayer,
namely “nanosome”, can be a new-generation smart nanomedicine platform
allowing for highly specific and efficient intracellular molecular targeting
therapy. Representative cell images (A549) showing intracellular distribution
of QD conjugates (green) when coincubated with human lung cancer cell lines
for 2 h (selected as the cover of ACS Chem. Biol. on September 2015). |
2022.11.30 NEW
北大発バイオベンチャー遠友ファーマがOpen Network Lab
HOKKAIDO 5th Batch Demo Dayで最優秀賞とオーディエンス賞をW受賞
プレスリリース
2022. 11.28 NEW
第12回GFRGプロジェクトシンポジウムを開催します(2023.1.19 北大学術交流会館)
皆様のご参加お待ちしております(学生無料、早期参加登録割引あり)
シンポジウムポスター
2022.4.7
先端生命科学研究院への寄附募集を開始しました
2021.12.22
西村教授と北海道大学発ペンチャー遠友ファーマ(株)の共同研究成果が、北大プレスリリースに掲載されました(2021年12月9日Biomaterials誌にオンライン掲載)
プレスリリース
2021. 9.9
クラウドファンディングプロジェクト終了。目標額達成しました!
「動的エピトープ理論」でウイルスの弱点を明らかにしたい! | academist (アカデミスト) (academist-cf.com)
~皆様からの温かい励まし、ご支援に心より感謝いたします。今後とも、ご指導よろしくお願いします~
2021. 8.24
北大のウエブマガジンにクラウドファンディングに関する記事が掲載されました!
#154 新型コロナウイルスの弱点を探る研究にクラウドファンディングで挑戦 – いいね!Hokudai
2021. 8月
YouTube教育番組、とつげき!ちきゅうの研究室「らぶラボきゅ~」に出演しました!
https://youtu.be/W8eVDdZt67o (8/7)
https://youtu.be/eV8ceXQUBgU (8/14)
2021.7.16
日経バイオテク(ONLINE)に、クラウドファンディングに関する記事が公開されました!
北大、SARS-CoV-2の新規治療薬開発へクラウドファンディング:日経バイオテクONLINE (nikkeibp.co.jp)
2021.7.7
クラウドファンディングプロジェクト開始しました!
「動的エピトープ理論」でウイルスの弱点を明らかにしたい! | academist (アカデミスト) (academist-cf.com)
北大プレスリリース
2020.4.1
西村紳一郎 教授が「令和2年度科学技術分野の文部科学大臣表彰」の科学技術賞(研究部門)に決定しました。
|