JAK-STAT経路を活性化・阻害する分子機構の解析
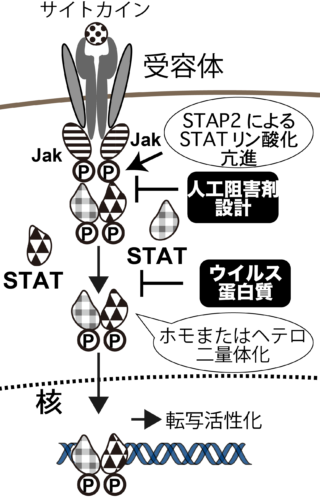
JAK-STAT経路は,「サイトカインの最も主要なシグナル伝達系」と言われ,50以上ものサイトカイン信号を捌く。典型的なJAK-STAT経路の活性化機構では,図1の通り膜貫通型受容体(IL-6受容体など)でサイトカインを感知し,細胞質ドメインにリクルートしたJAK等のチロシンキナーゼ(TK)がSTATをリン酸化する。STATはホモ,あるいはヘテロ二量体化し核移行した後,ターゲットDNA配列に結合・転写因子として機能し,下流の遺伝子発現を調節する(図1, 2)。JAK-STAT経路は細胞の分化,発達,増殖,生存維持に関連し,特に細胞増殖を促進するシグナル伝達経路の異常な活性化はがんの原因となるため,そのメカニズムを解明することは抗自己免疫疾患や抗がん治療法の開発に重要である。一方でJAK-STAT経路はインターフェロン(IFN)受容体下流でも働き,自然免疫・獲得免疫発動を通じて感染防御機構のコアを担う。しかしいくつかの高病原性ウイルスは,宿主免疫系であるこのJAK-STAT経路を積極的に阻害するため,ウイルスの宿主指向性や強毒性発現に深く関わる。各IFNによる応答経路という観点からは, STAT1, STAT2が取り上げられるが,ウイルス蛋白質によっては,これ以外にSTAT3とも相互作用し,STATリン酸化にともなったヘテロ二量体形成能など複雑なクロストークのうち特定のものを阻害する。STATが発見された1988年以降,個々の膨大な研究例が蓄積されたが,クロストークの全容や調節因子が機能する分子メカニズム等多くの未解明現象が残っている。本研究室では炎症・免疫疾患や感染防御の観点からJAK-STAT経路の活性化・阻害機構解明に向け独自視点により取り組んでいる。


- The measles virus V protein binding site to STAT2 overlaps that of IRF9
Yuma Nagano, Aoi Sugiyama, Madoka Kimoto, Takuya Wakahara, Yasuyo Noguchi, Xinxin Jiang, Shinya Saijo, Nobutaka Shimizu, Nana Yabuno, Min Yao, Paul Gooley, Gregory Moseley, Takashi Tadokoro, Katsumi Maenaka, *Toyoyuki Ose
J. Virol. 94, e01169-20 (2020) - Structural comparison of the C-terminal domain of functionally divergent lyssavirus P proteins.
Aoi Sugiyama, Tomo Nomai, Xinxin Jiang, Miku Minami, Min Yao, Katsumi Maenaka, Naoto Ito, Paul R Gooley, Gregory W Moseley, *Toyoyuki Ose
Biochem. Biophys. Res. Commun., 529 507 – 512 (2020) - Hossain MA, Larrous F, Rawlinson SM, Zhan J, Sethi A, Ibrahim Y, Aloi M, Lieu KG, Mok YF, Griffin MDW, Ito N, Ose T, Bourhy H, Moseley GW, Gooley PR.
Structural Elucidation of Viral Antagonism of Innate Immunity at the STAT1 Interface.
Cell Rep. 29, 1934-1945(2019) - Zhan J, Hossain MA, Sethi A, Ose T, Moseley GW, Gooley PR
1H, 15N and 13C resonance assignments of the C-terminal domain of the P protein of the Nishigahara strain of rabies virus.
Biomol NMR Assign. 1, 5–8 (2019)
酵素反応解析
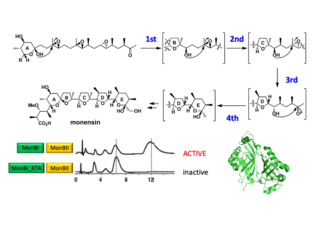
酵素は高度な立体選択性・位置選択性を備え,複雑な化学反応を簡単に触媒する。私達は生理活性を持った天然化合物(天然物)の生合成や,RNA修飾に関わるもの,新奇酵素反応をマルチモーダルな方法により解析している(図3)。酵素の中には,量子トンネル効果やラジカル対形成など,有機化学だけでは説明できず量子力学による解釈が必要なものも多く存在するとされている。水素の位置・挙動を明らかにすることがキーとなるものも存在するため,X線,電顕,NMRで追跡できないものに関しては,中性子線回折を取り入れている。中性子線結晶構造解析は発展途上の手法論であるため,結晶成長など方法論の開発もおこなっている。
- Long Li, Motoyasu Adachi,Jian Yu, Koji Kato, Akira Shinoda, Andreas Ostermann, Tobias E. Schrader, Toyoyuki Ose, and Min Yao
Neutron crystallographic study of heterotrimeric glutamine amidotransferase CAB.
Acta Cryst. F76, 193-196 (2019) - Allosteric regulation of epoxide opening cascades by a pair of epoxide hydrolases in monensin biosynthesis
Atsushi Minami, Toyoyuki Ose, Kyohei Sato, Azusa Oikawa, Kimiko Kuroki, Katsumi Maenaka, Hiroki Oguri, and Hideaki Oikawa
ACS Chem. Biol. 9, 562-9 (2014) - Crystal structure analysis of geranyl pyrophosphate methyltransferase and the proposed reaction mechanism of SAM-dependent C-methylation
Orapin Ariyawutthiphan, *Toyoyuki Ose, Atsushi Minami, Sandip Sinde, Muneya Tsuda, Yong-Gui Gao, Min Yao, Hideaki Oikawa, and Isao Tanaka
Acta Cryst. D68, 1558-1569 (2012) - Remarkable synergistic effect between MonBI and MonBII on epoxide opening reaction in ionophore polyether monensin biosynthesis
Kyohei Sato, Atsushi Minami, Toyoyuki Ose, Hiroki Oguri, and Hideaki Oikawa
Tetrahedron Letters, 52, 5277-5280 (2011)
RNA修飾酵素
熱水噴出孔のような高温環境でも生存できる生物は,どのような生存戦略を採っているのでしょうか?その答えの一つが,運搬リボ核酸(tRNA)の転写後修飾です。tRNAはアンチコドンに応じてアミノ酸を運び,蛋白質の合成に欠かせない分子です。しかし,生体内で転写された直後の未成熟tRNAは,熱安定性や翻訳の正確性が低いため,様々な酵素による修飾を受けて成熟化します。本研究で着目しているtRNA 54位の5-メチル-2-チオウリジン修飾(硫黄修飾, m5s2U54)は,tRNAの変性温度を65℃から約90℃に高め,高熱菌が70℃以上で生存するために必須の修飾として機能します。
当研究室では,この硫黄修飾を触媒する2-チオウリジン合成酵素(TtuA)と硫黄ドナー蛋白質TtuBの複合体のX線結晶構造解析に成功し,TtuAの酵素活性には空気中で容易に酸化崩壊する[4Fe-4S]鉄硫黄クラスターが必須であることを発見しました[1]。さらに,鉄硫黄クラスターを構成する四つの鉄のうち,TtuAのシステイン残基に結合していない露出した鉄(ユニーク鉄)がTtuBの硫黄を受け取ることを明らかにしました[2]。
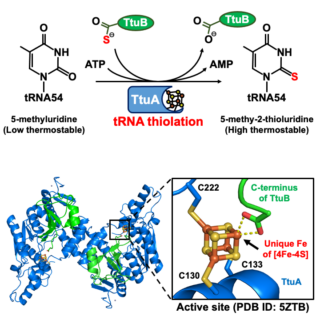
近年では,ヒトtRNA 34位(アンチコドン1位)の硫黄修飾の異常が,ガンの浸潤転移やミトコンドリア病に関連することも報告されています。興味深いことに,この硫黄修飾を触媒するNcs6の構造や機能はTtuAとよく似ていますが,鉄硫黄クラスターの種類は異なる可能性が示唆されています。また,TtuAやNcs6がどのようにtRNAと相互作用し,tRNAが硫黄を受け取れる状態にするかは明らかでありません。現在は,これらの問題を解決するために,鉄硫黄クラスターを利用するtRNA硫黄修飾の反応機構解明を目指しています(図4)。
参考文献
1. Quick and spontaneous transformation between [3Fe-4S] and [4Fe-4S] iron-sulfur clusters in the tRNA-thiolation enzyme TtuA
Masato Ishizaka, Minghao Chen, Shun Narai, Yoshikazu Tanaka, Toyoyuki Ose, Masaki Horitani, Min Yao.
International Journal of Molecular Sciences. 24(1), 833 (2023)
https://www.mdpi.com/1422-0067
2. The [4Fe-4S] cluster of sulfurtransferase TtuA desulfurizes TtuB during tRNA modification in Thermus thermophilus
Minghao Chen, Masato Ishizaka, Shun Narai, Masaki Horitani, Naoki Shigi, Min Yao & Yoshikazu Tanaka.
Commun. Biol. 3, 168 (2020)
https://www.nature.com/article
3.Biochemical and structural characterization of oxygen-sensitive 2-thiouridine synthesis catalyzed by an iron-sulfur protein TtuA
Minghao Chen, Shin-ichi Asai, Shun Narai, Shusuke Nambu, Naoki Omura, Yuriko Sakaguchi, Tsutomu Suzuki, Masao Ikeda-Saito, Kimitsuna Watanabe, Min Yao, Naoki Shigi, and Yoshikazu Tanaka
Proc. Natl. Acad. Sci. USA 114(19), 4954-4959 (2017)
https://www.pnas.org/doi/10.10

