黄色ブドウ球菌の2成分性毒素γ-ヘモリジンの膜孔構造形成機構の解明
Summary
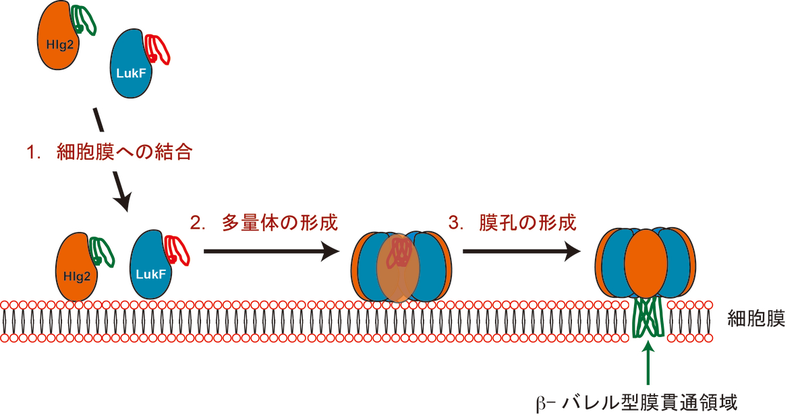
黄色ブドウ球菌は,ホスト細胞の血球を崩壊させるための,様々な膜孔形成毒素蛋白質を分泌する.
黄色ブドウ球菌の膜孔形成毒素は,単一の分子で構成されるα-ヘモリジンと, 2つの成分から構成される2成分性毒素に分類される.
いずれの分子も可溶性の単量体として発現され,ターゲット細胞の表面で会合した後,多量体の膜孔を形成する(図1).
これまでに,α-ヘモリジンの7量体の膜孔構造と2成分性毒素の単量体構造の立体構造がX線結晶構造解析により明らかにされてきたが,2成分性毒素の膜孔構造は未知であった.
本研究では,2成分性毒素の1つである,γ-ヘモリジン(Hlg2とLukFから構成される)の膜孔構造を2.5Åの分解能で決定し,2成分性毒素の膜孔形成機構の詳細を明らかにした.
このモデルは,過去20年におよび蓄積されてきた黄色ブドウ球菌2成分性毒素の生化学的研究を適切に説明するものである.
γ-ヘモリジンの膜孔構造
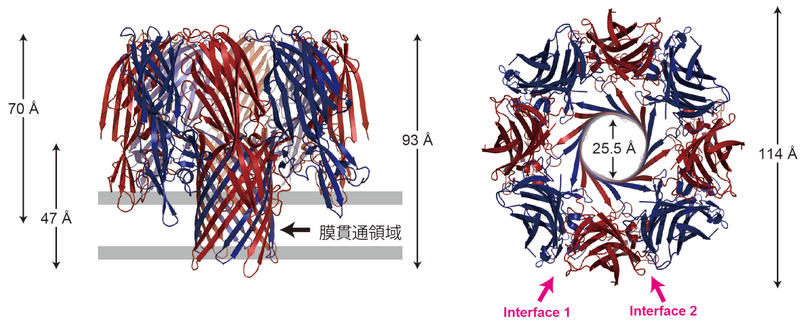
LukFとHlg2が4分子ずつ,交互に円状に配置した8量体構造を形成していた(図2).
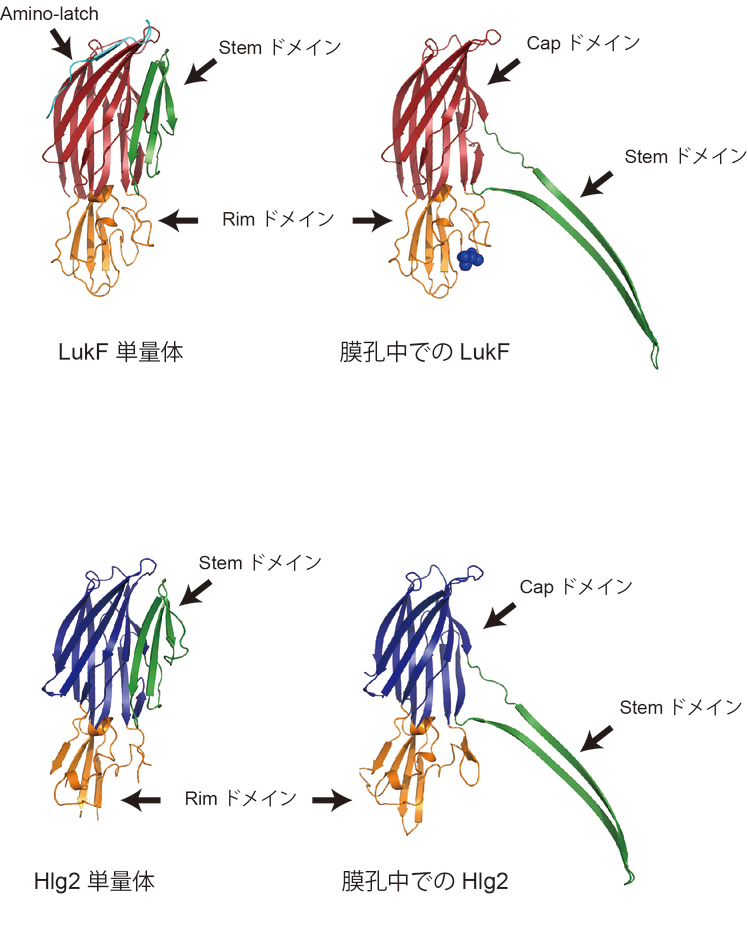
単量体中では折り畳まれていたステム領域が伸び(図3),2成分が交互に配置してβ-バレル型の膜貫通領域を形成していた.
膜孔の直径は25.5Å,膜外領域の直径は114Åであった.
8量体中には,2種類の分子接触界面(Hlg2-LukFの界面(Interface 1)とLukF-Hlg2の界面(Interface 2))が存在していたが,それぞれの接触面積は1068Å2,831Å2と大きく異なっていた.
提案された膜孔形成機構
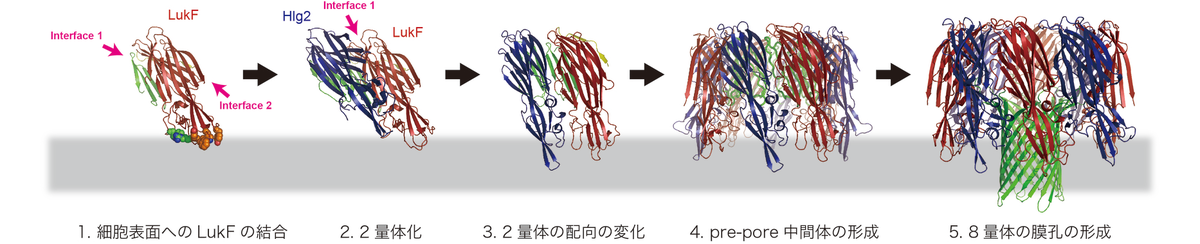
今回明らかになった膜孔構造と,既知の単量体構造,さらに,これまでに報告されてきた生化学的データをもとに,2成分性毒素の膜孔形成機構を提案した(図4).
まず,LukFが赤血球膜上に結合する(状態1).このとき,LukFはInterface 1を上に向けるように,膜に対して斜めに結合する.
次に,上に向けられたInterface 1にHlg2が結合する(状態2).
形成された2量体は向きを変えて,LukFとHlg2の底部で膜に結合する(状態3).
2量体同士が会合し,pre-poreと呼ばれる膜孔中間体を形成する(状態4).
Pre-poreの状態では,ステム領域は伸長せず,膜孔は形成されない.
最後に,ステム領域が大きく構造変化し,膜孔が形成される(状態5).
Reference
- K. Yamashita, Y. Kawai, Y. Tanaka, N. Hirano, J. Kaneko, N. Tomita, M. Ohta, Y. Kamio, M. Yao, and I. Tanaka, Crystal structure of the octameric pore of staphylococcal γ-hemolysin reveals the β-barrel pore formation mechanism by two components. Proc. Natl. Acad. Sci. USA, 108, 17314-17319 (2011)
[Pubmed]
[PDB: 3B07]