「翻訳開始段階における開始コドン認識機構の解明」
• はじめに
真核生物では細胞の内部が様々な細胞小器官により分画されており,比較的一様な細胞内部構造をもつ原核生物と比較して,はるかに複雑に生体物質の分布や代謝,挙動が制御されている.特に遺伝情報発現に際して,核膜の存在により転写と翻訳が時間・空間的に分離されているため,転写後のプロセスがより大きな役割を果たすようになっている.中でも翻訳効率の調節は最終的な産物であるタンパク質の量を調節するという意味で重要な段階であり,mRNAの成熟化や輸送・局在,品質管理,代謝効率と直接的に連携しながら,細胞周期,細胞分化,アポトーシス,がん化,細胞休眠など細胞活動全体の調節,ひいては免疫応答や長期記憶,糖尿病,飢餓応答など個体生存に必須な生理現象と密接に関連している.
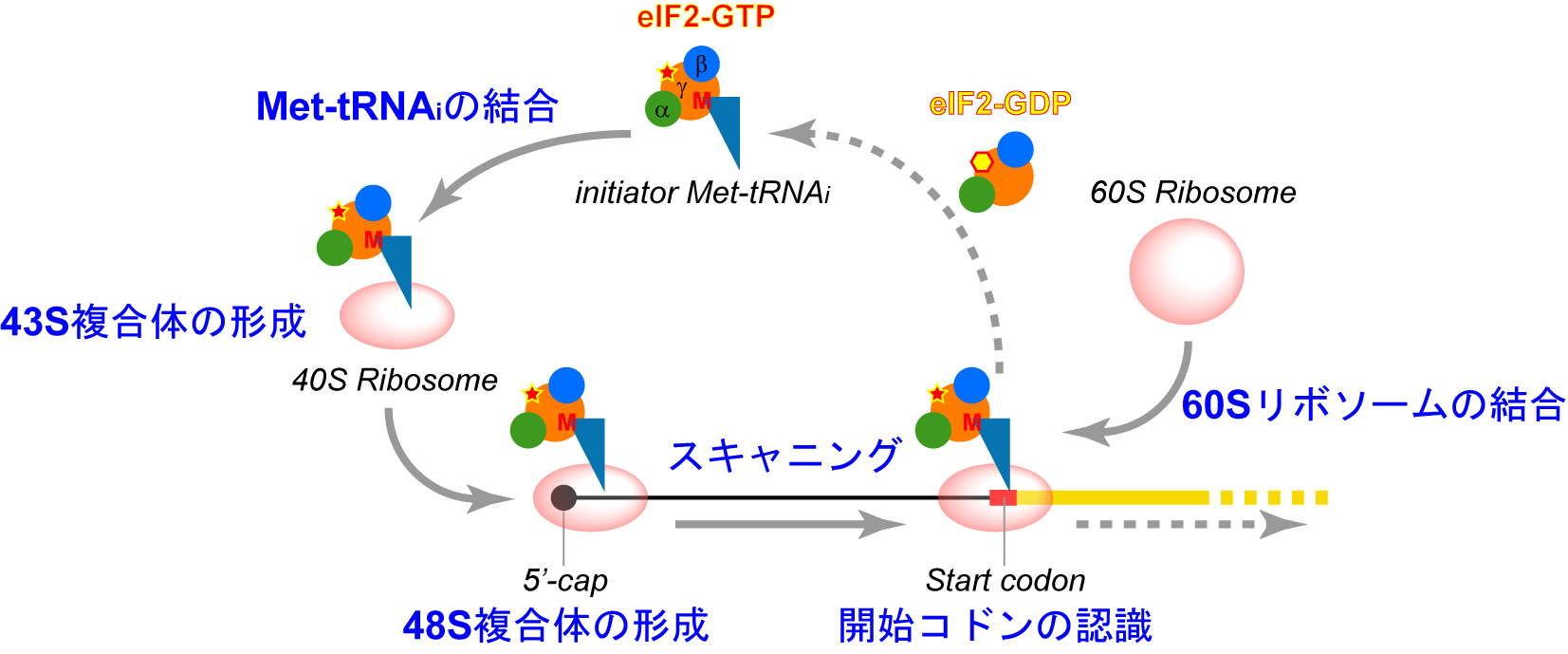
図1.真核生物の翻訳開始段階
開始段階はMet-tRNAiと40Sリボソームの結合に始まり,80SリボソームPサイトにてMet-tRNAiが開始コドン認識した状態で終わる.
翻訳反応は便宜的に開始,伸長,終結の3つの段階に分けることができ,翻訳効率は主に開始段階で調節されている.真核生物の開始段階は原核生物のものと比較して高度に複雑化しており,このことからも真核生物における翻訳調節の重要性をうかがうことができる.開始段階では最終的に80SリボソームのPサイト上にmRNAの開始コドンと開始メチオニルtRNA(Met-tRNAi)のアンチコドンが対合した状態で配置されるが,そこへ至るまでにMet-tRNAiと40Sリボソーム小サブユニットの結合(43S開始前複合体の形成),43S複合体とmRNA5'末端の結合(48S複合体の形成),開始コドンのスキャニング,開始コドンの認識,60Sリボソーム大サブユニットの結合(80Sリボソームの形成)という過程を経る(図1).これらの素過程には真核生物型開始因子(eukaryotic Initiation Factor: eIF)と呼ばれる30余りのタンパク質が必須であり,それぞれの開始因子が互いに協調的に働きながら,リボソーム,Met-tRNAi,mRNAの挙動を厳密にコントロールしている.また,これら開始因子の活性は様々な刺激に応答して調節されており,結果としてmRNAの翻訳効率に直接的な影響を与える.
eIF2はα,β,γの3サブユニットから成る開始因子で,GTP依存的にMet-tRNAiを40Sリボソームへと運搬し,さらに開始コドンの認識に応じてGTP加水分解によってMet-tRNAiから解離することで続くプロセスを誘導するという2つの中核的な役割を担っている.また,ウイルス感染や栄養飢餓,熱ショック,記憶刺激などに応答してeIF2αサブユニットがリン酸化され,mRNA全体の翻訳活性の低下と一部の遺伝子の活性化を誘導し,最終的に細胞死や休眠,免疫応答,記憶応答などを引き起こすことが知られている.長年の研究により,eIF2各サブユニットの個々の役割はある程度詳細に解析されてきている.eIF2γはeIF2αとeIF2βをつなぐ構造的コアサブユニットであり,GTP,Met-tRNAiとも直接的に相互作用する機能的なコアでもある.また,eIF2γはEF1A(ペプチド伸長段階においてアミノアシルtRNAをリボソームAサイトにGTP依存的に運搬する伸長因子)と相同性を有していることから,類似したメカニズムでMet-tRNAiを結合すると考えられている.eIF2βはeIF5やeIF2Bなど他の開始因子との足場的役割を持つN末端領域とHelix-turn-helixおよび亜鉛結合モチーフを有しているコア領域から成る.コア領域はGTP加水分解やRNA結合との関与が指摘されているが,はっきりとした機能は未だ同定されていない.eIF2αは先にも述べたようにリン酸化を受けて翻訳調節に大きく関わることが知られているが,その他にMet-tRNAi結合や開始コドンの認識に関与すると考えられている.このようにeIF2サブユニットは個々独立した機能を有しているが,これらのサブユニットが実際にどのように連携し,協調的に機能性を発揮するのかについてはこれまで にほとんど明らかにされていない.
そこで我々は古細菌由来eIF2ホモログであるaIF2†のβγサブユニット複合体のGDP結合状態の立体構造から,特に両サブユニット間の詳細な相互作用や構造変化の解析を行った.
†aIF2はeIF2と同様にα,β,γサブユニットから成り,機能的にも相同であることが確認されているが,βに関してはeIF2βのコア領域のみを有している.
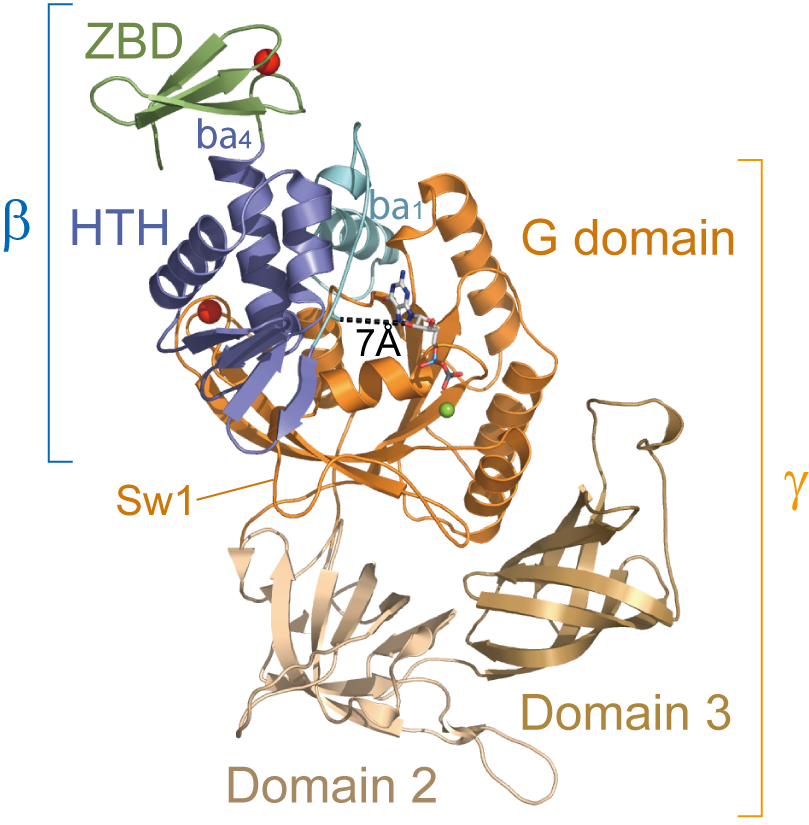
図2.aIF2βγ-GDP複合体の構造
γはG,2,3,βはα1,HTH,ZBDのそれぞれ3つの領域から成る.βはα1とHTHを介してγのGドメインのみとGDPを取り囲むように相互作用している.
• aIF2βγ複合体の全体構造
aIF2βγ複合体構造においてγはN末端から順にGドメイン,ドメイン2,ドメイン3,βはN末端のα1ヘリックス,Helix-turn-helixドメイン(HTH),亜鉛結合ドメイン(ZBD)から構成されており,サブユニット単体のドメイン構造とほぼ類似していた(図2).βはγのGTP/GDP結合サイトを取り囲むように結合しており,特にGTP結合の重要な保存モチーフであるSwitch1およびP-loopと直接的に相互作用していたことから,βはGTP加水分解に関連していることが示唆される.一方,βはγのGドメインとのみ相互作用していたことから,過去に指摘されていたβとMet-tRNAiの直接的な結合の可能性は否定される.また,βはα1とHTHのみを介してγと相互作用しており,ZBDは溶媒側に突出していた.α1はγの疎水表面と非常に広域かつ強固に疎水結合しており,相互作用している残基も両サブユニット共に高く保存されていることから,β-γ間の結合の特異性に深く関与していると思われる(図3A).一方,HTHは主に水素結合を介してP-loopおよびSwitch1と相互作用していたため,機能的に重要な相互作用である可能性が示唆される(図3B).また,HTH-γ間の結合面は比較的狭くルーズであり,かつα1とHTHはフレキシブルなループで連結されていることから,HTH-γ間の結合が比較的高い自由度を有している可能性が示唆される.
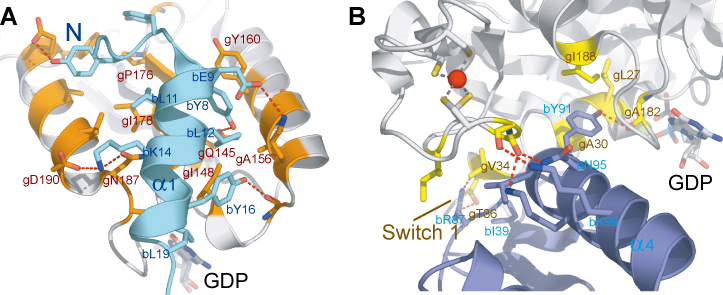
図3.aIF2b-aIF2gの結合
(A). α1 (水)-γ間の相互作用.おもに疎水性相互作用により非常に広範囲で相互作用している.また相互作用している残基の保存性も非常に高い.
(B). HTH(青)-γ間の相互作用.おもに水素結合で比較的狭い領域ではあるが,
Switch1領域やP-loopなどGTP結合に重要なモチーフと相互作用している.
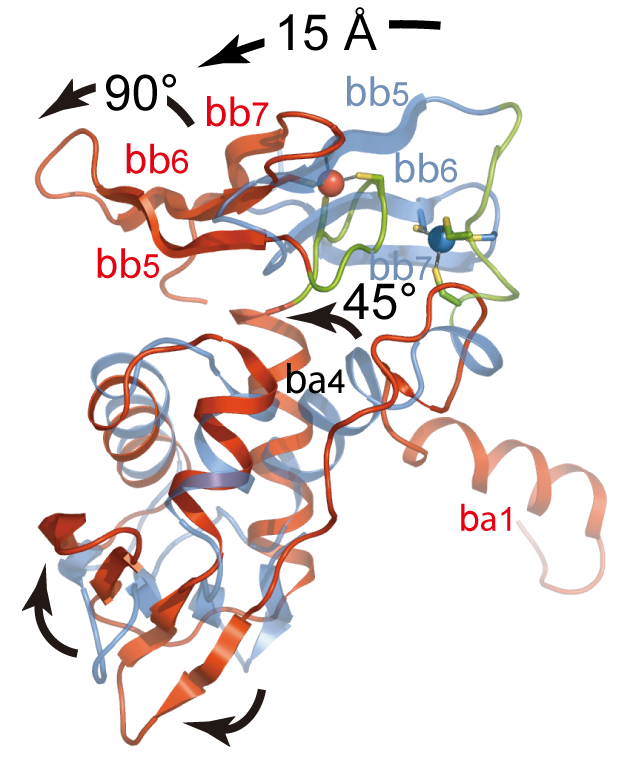
図4.β単体との構造比較
βγ複合体中のβ(赤)とβ単体(青)のHTH部分の重ね合わせ.矢印は大きく構造変化している部分を示している.
• βサブユニットの構造的フレキシビリティ
βγ複合体構造を過去に解析されたaIF2β単体のNMR構造と比較したところ,ZBDとHTHの相対的関係が大きく変化していることが明らかになった(図4).この変化は主にHTH-g間の相互作用によってHTHとZBDを連結しているα4ヘリックスが約45°回転していることと,亜鉛結合モチーフの構造変化によってZBD全体が約90°回転していることが主な要因であると考えられる.結果としてZBDはHTHに対して比較的近接した配向をしており,両ドメイン間にいくつかの水素結合が形成されている.これはβ単体構造においてZBDはHTHと全く相互作用していなかったことと対照的である.β単体構造の機能的意義は定かではないため,この構造比較は直接的には意味を成さないが,少なくともβ(特にZBDおよびα4)の構造的自由度が本質的に高いことを表していると言えるだろう.過去にZBDの変異がeIF2単体のGTP加水分解活性を著しく昂進させることが明らかにされているが,ZBDがヌクレオチドから遠く離れていることを考えると,簡単には説明できない.しかしながら,この構造比較でみられた様なZBDおよびα4の構造変化が何らかの機能的意義を内包しているとすると,たとえばZBD,α4の構造変化が間接的にHTHとswitch1, P-loopの相互作用に影響を与える可能性が考えられる.さらにZBDにはRNA結合活性もあるため,ZBDがRNAを介したシグナルに応じて構造変化する可能性もあり得るだろう.
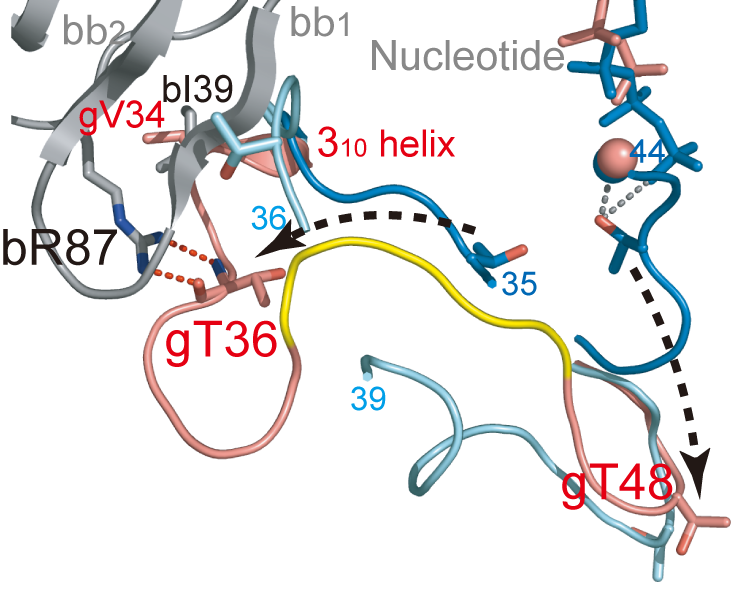
図5.Switch1領域の比較
βγ-GDP(赤),αγ-GTP(青),γ-GDPのSwitch1領域の
重ね合わせ.βγ-GDP中のβを灰色で表している.黄色はSwitch1領
域でMet-tRNAi結合に関与する残基.矢印はGTP型とGDP型で大きく構造変
化している部分を示している.
• Switch1領域の構造変化
先に述べたようにγは伸長因子EF1Aと構造・機能的類似体である.EF1AではSwitch1領域がGTP結合状態でGTPのγ-リン酸とアミノアシルtRNAと相互作用しており,加水分解に伴って構造変化を引き起こしてアミノアシルtRNAの解離に寄与することが知られている.近年,aIF2αγ-GTP複合体の構造にてSwitch1領域が実際にEF1Aの同領域と類似の構造をとっていたことから,aIF2においてもSwitch1領域の構造変化がMet-tRNAi解離に関与すると考えられている(図5).興味深いことに今回解析したGDP結合型のβγ複合体においてSwitch1のN末端領域がHTHと相互作用しており,結果としてSwitch1領域全体がヌクレオチドから大きく離れた構造を取っていた(図5).Switch1領域はβのHTHとγ本体の間に挟み込まれるよう位置しているため,Switch1領域はHTH全体が大きく移動しない限りαγ複合体で見られたようなGTP型のコンフォメーションを取ることは不可能であると思われる.実際に我々がApo型のβγ複合体の結晶をGDP或いはGTPにそれぞれソーキングした際にも,GTPにソーキングしたときのみ結晶が速やかに崩壊したことが観察されており,βγ複合体はGTP型とGDP型で大きく構造変化することが示唆されている.このことと先に述べたβの構造的自由度の高さを考慮すると,GTP→GDP型に変化する過程でβサブユニットの構造変化が重要な役割を果たすことが強く示唆される.
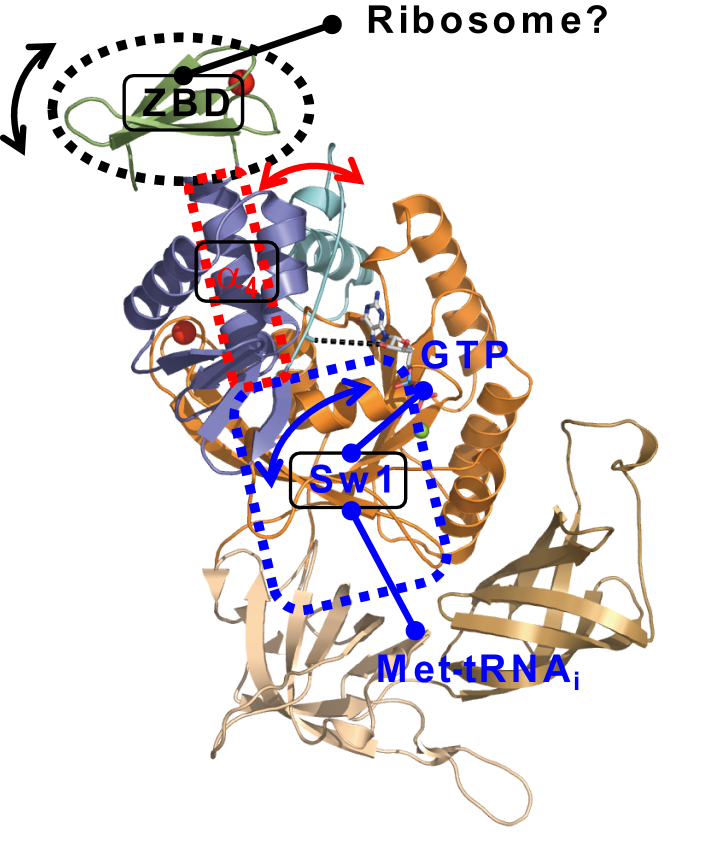
図6.βの構造変化によるGTP加水分解誘導モデル
両矢印が構造変化,直線が相互作用する相手を表している.ZBDはリボソーム,Switch1領域はGTP,Met-tRNAiと相互作用する.ZBDとSwitch1領域をつなぐ領域は構造変化する
• 総括
βγ-GDP複合体の構造解析より,βのZBDとα4が高い自由度を持つことと,Switch1領域がGTP型の構造を取るためにはHTHの構造変化が必須であることが明らかとなった.これらのことと,GTPから遠く離れたZBDの変異がGTP加水分解に強い影響を与えること,ZBDがRNA結合活性を持つことを併せて,我々は開始コドン認識シグナルがrRNAを介してZBD→α4→HTHの構造変化を誘導し,最終的にGTP加水分解→Switch 1領 域の構造変化→Met-tRNAiの解離を引き起こすという新しいモデルを提唱している(図6).本研究はこれまで全く未知であったβコア領域の機能や,βとγサブユニット間の機能的連携に新たな知見を与えたという意味で非常に有意義であると思われる.