�V�R�^�^���p�N���̗��̍\�����
���w�����Ȑ����Ȋw��U���̍����q��͊w�u���Q
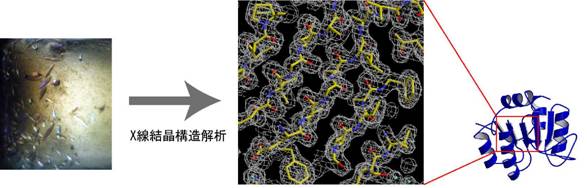
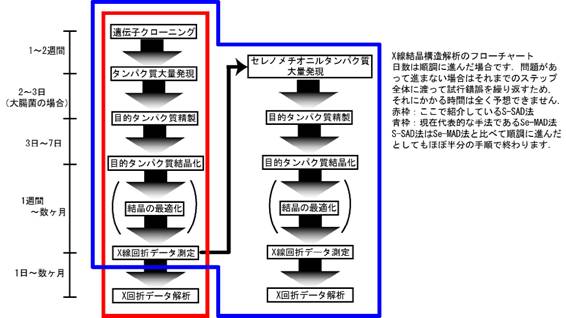
���������ł�X�������\����͂ɂ���ă^���p�N���̗��̍\�������q���x���Ŗ��炩�ɂ��邱�Ƃ����͂ȕ���Ƃ��Ă��܂��D�������C���ۂ�X�������\����͂��s�����Ǝv���Ɨl�X�Ȗ������z���Ȃ���Ȃ�܂���D���̃g�s�b�N�ł͓V�R�^�̃^���p�N���̂܂܂ŁC����Ɏ������Ŏg�p���Ă���X���������u�ō\����͂��ł��Ă��܂��V�������@���Љ�܂��D���̕��@��X�������\����͖@�����v���ɁC�����ɁC�ȒP�ɍs�����Ƃ��ł���傫�ȉ\�����߂Ă��܂��D
1.
X�������\����͖@
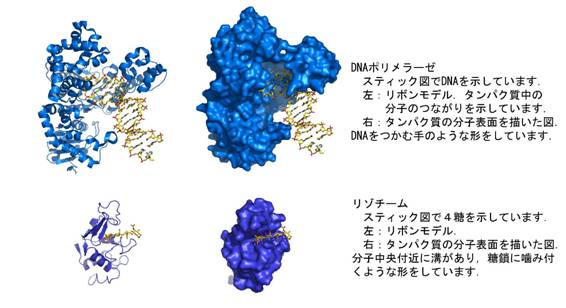
�^���p�N���͐������`����Ă����\�I�Ȑ��̍����q�ł��D�^���p�N���ɂ͖����Ƃ�������o���G�[�V����������C���w�����𑣐i��������́C���̕�����A��������́C�^���p�N�����g��DNA�CRNA�Ƃ�������`���������ۂɂ�����̂ȂǁC���ꂼ��l�X�ȋ@�\�������ē����Ă��܂��D���̂悤�Ȑ������̃^���p�N���ɋ��ʂ��Ă���̂́C���̃^���p�N���̗��̓I�ȍ\���Ƌ@�\�̊Ԃɑ傫�ȊW������Ƃ������Ƃł��D���Ƃ��C�������̍זE��j�郊�]�`�[���Ƃ����^���p�N���͍זE�ǂ��\�����铜�������킦���ތ`�����Ă��܂����CDNA��L���Ă���DNA�|�������[�[�Ƃ����^���p�N���͂��܂�DNA��߂܂����̂悤�Ȍ`�����Ă��܂��D
����ă^���p�N�����ǂ�Ȍ`�����Ă���̂����킩��Ɣ��ɑ����̗L�v�ȏ������̂ł��D���Ƃ����̃^���p�N���̔��������i�߂���t�Ɏז������肷�镨����\�������������肷�邱�Ƃ��ł��邩������܂���D�����̌������̋��͂ȕ���ł���X�������\����͂�p����ƁC�^���p�N���̗��̍\�������q���x���i�i�m�X�P�[���j�Ŗ��炩�ɂ��邱�Ƃ��\�ł��D���}��X�������\����͂ɂ���ă^���p�N���̗��̍\�����𖾂���܂ł̑�܂��ȗ���Ƒ�\�I�Ȗ��_�������܂��D
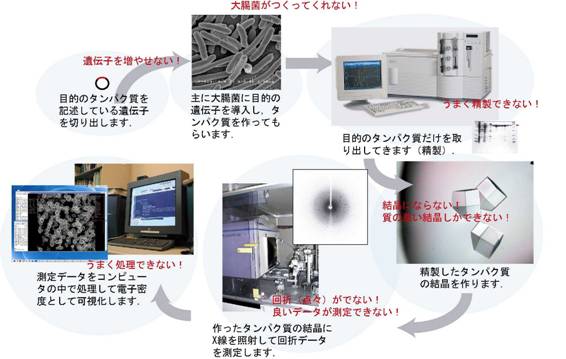
���̂悤�ɗ��̍\���̉𖾂Ɏ���܂łɂ͑����̏�Q���҂��Ă��܂����C�����ɏЉ�錤���őΏۂƂ��Ă���̂́C�f�[�^����ɂ��Ă̈��@�ł��D
2.
S-SAD�@�ƒ��g��X���̗��p
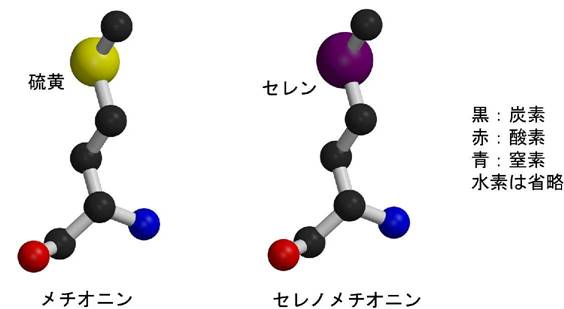
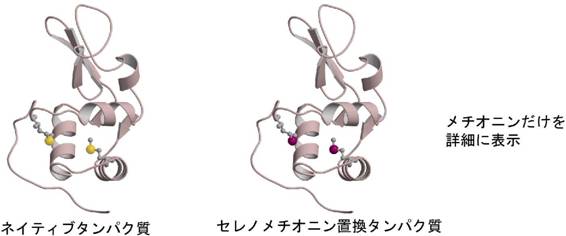
�]���ł́C�^���p�N���̗��̍\���𖾂炩�ɂ��邽�߂Ƀ^���p�N�������Ɏ��������K�v������܂����D�V�R�ɑ��݂���`�̓V�R�^�^���p�N���̂܂܂ł́C������ǎ��Ȍ������ł��Ă��\����͂͂ł��Ȃ������̂ł��D�ʑ����̂��߂̃^���p�N�����ςōł���\�I�Ȃ��̂́C�^���p�N���̌����ɐ������C�����C�E�����C�I�X�~�E���C�����^�m�C�h���q�Ȃǂ̏d���q���C�����̒��Ń^���p�N���Ɍ������邱�Ƃ����҂��ėn�t�ş��ݍ��܂�����@�ł��D���̏d���q������Ζڈ�Ƃ��Ă��Ƃ��Ƃ̓V�R�^�^���p�N���̌����i�l�C�e�B�u�����ƌĂт܂��j�Ƃ́u���v����\����͂��s�����Ƃ��\�ł��D������d���q�u���@�ƌ����C���݂ł����ɋ���ȃ^���p�N���̍\����͂ȂǂŎg���Ă��܂����C�d���q�n�t����݂��܂���ۂɌ����������C���̌����̌`����傫�������C�^���p�N���ɏd���q���������Ă���Ȃ��i���肵�Ȃ��Ƃ킩��܂��j�Ȃǂ��܂������Ȃ��ꍇ�����X����܂��D90�N��ɂȂ��ēo�ꂵ���̂��Z���m���`�I�j���^���p�N���̒����Ƒ��g���ُ�U���@�ł��D�Z���m���`�I�j���^���p�N���̒����́C�^���p�N���ɖڈ�ƂȂ�d���q���ł���m�������I�ɏグ������I�Ȏ�@�ł��D�咰�ۂɖړI�^���p�N������点��Ƃ��ɃA�~�m�_�̈�ł��郁�`�I�j���̑���ɁC���`�I�j���̗������Z����(Se)�ɒu�����ꂽ�Z���m���`�I�j����^���܂��D���`�I�j���ƃZ���m���`�I���͐��������ɂ悭���Ă���̂ő咰�ۂ͂��肩����Ă��邱�ƂɋC�t�����Ƀ��`�I�j�����Z���m���`�I�j���ɒu����������u���^���p�N��������Ă��܂��̂ł��D
����ɑ��g���ُ�U���@(MAD�@)�Ƃ́C��̌����ɑ���3��̔g���Ńf�[�^������s���C2�ȏ�̃f�[�^�Z�b�g�Ԃ̍�����\�������߂��@�ł��D�d���q�u���@�ł̓l�C�e�B�u�����Əd���q�����������������̊Ԃō����Ƃ��Ă��܂������CMAD�@�ł͑���g���̈قȂ�f�[�^�Z�b�g�̊Ԃō����Ƃ�܂��DMAD�@�͏d���q�u���@�ƈقȂ�C��x�̃f�[�^����ōς�ł��܂���Ɉ�̌��������g��Ȃ����߁C�l�C�e�B�u�����Ƃ̍����C�ɂ���K�v���Ȃ��Ȃ�܂��D
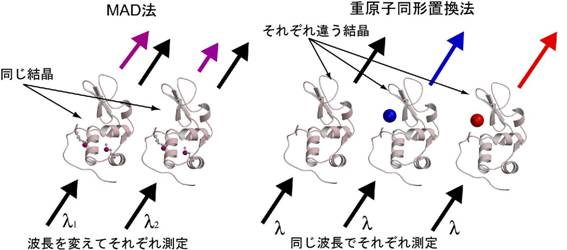
�Z���m���`�I�j���^���p�N���̒�����MAD�@��g�ݍ��킹�邱�ƂŃ^���p�N���̗��̍\�����𖾂���J�͂Ǝ��Ԃ͑啝�ɒZ�k����C����10�`20�N�̊Ԃɖ��炩�ɂ��ꂽ�^���p�N���̗��̍\�����͎w�����I�ɑ������Ă��܂��D
���̂悤�ɔ��ɕ֗��ȃZ���m���`�I�j���u���^���p�N���̑��g���ُ�U���@�ɂ��\�����(Se-MAD)�ł����������F�X�s�ւȂ��Ƃ�����܂��D�Z���m���`�I�j���u���^���p�N����咰�ۂɍ���Ă��炤�Ƃ��ɋۂ��炽�Ȃ��Ȃ�C��点���^���p�N�������ɗn���Ȃ��Ȃ��Ă��܂��C�^���p�N���̐������傫���ς���Ă��܂��C�����ɂȂ�Ȃ��Ȃ��Ă��܂��Ȃǂ̖�肪�N���邱�Ƃ�����܂��D�܂�قƂ�Ǖʂ̃^���p�N����V���ɐ����C���������Ȃ����قǂ̘J�͂��K�v�ƂȂ�ꍇ������̂ł��D�܂��C���g���ُ�U���@�̍ő�̓����͈�x�ɕ����̔g�����g�p���邽�߁C�g���̕ύX���\�Ȓ���^�{�݁C���ˌ��{�݂Ŏ������s���K�v������Ƃ������Ƃł��D�܂肱�̎�@�ł͂����������Ō�������邱�Ƃ��ł����Ƃ��Ă��C���̌�������ˌ��{�݂܂ʼn^��ő��肳���Ă��炦�Ȃ���C�ǂ�Ȃɗǂ��������ł��Ă�������܂˂��Č��Ă��邵���Ȃ��̂ł��D

Se-MAD�@��������Ɏ�y��X�������\����͂��s�����@�Ƃ��Ă���10�N�قǑ傫���i�����Ă��Ă���̂��C���̌����Ŏg���Ă��闰����p�����P�g���ُ�U���@�iS-SAD�@�j�ł��D���̕��@�ł̓^���p�N�����ɂ��Ƃ��Ɗ܂܂�闰�����q��ڈ�Ƃ��č\����͂��s�����߁C�^���p�N���̌�����^���p�N�����̂��̂����ς���K�v������܂���D�܂�V�R�^�̃^���p�N���ō\����͂��ł��Ă��܂��̂ł��D����ɒP�g���ُ�U���@�iSAD�@�j��MAD�@�̂悤�ɕ����̔g�����g�킸�ɁC��g�������ō����Ƃ��č\����͂����Ă��܂����߁C���ˌ��{�݂ɍs�����Ƃ��������K�͂�X���������u�Ńf�[�^���肪�ł��Ă��܂��̂ł��D
 �@
�@
����ȂɊȒP�Ȃ�S�����̕��@�ō\����͂����������Ȃ����Ǝv����ł��傤���C�������ȊȒP�ɂ͂����܂���D��ԑ傫�Ȗ��͏d���q��Z�����ɔ�ׂė����͂��Ȃ�y���������Ƃ������Ƃł��D�\����͂��s���ɂ͂܂��ڈ�ƂȂ錴�q�̈ʒu�����肵�Ă��猳�Ƃ́u���v�𗘗p���邱�Ƃ͑O�ɏq�ׂ܂������C�������炢�̑傫���ł͑���덷�ɖ�����Ă��܂��āu���v�m�ɑ��肷�邱�Ƃ�����Ȃ�܂��D�܂��CSAD�@��MAD�@�ɔ�ׂĈ�ʓI�ɍ������x���K�v�ł���X�����������߁C�����𗘗p����S-SAD�@�ł͗����̏��������������x�ő��肵�Ȃ���Ȃ�Ȃ��Ƃ�����d�̍�����̂ł��D���̖����ɘa������@�Ƃ��Ĕg���̒���X���𗘗p������@������Ă��܂��D�f�[�^����ő������u���v�͗����̏ꍇ�ł͔g����������Β����قǑ傫���Ȃ邩��ł��D�������g���̒���X�����g�p����f�����b�g������܂��DX���͔g���������Ȃ�قǕ����Ƃ̑��ݍ�p���傫���Ȃ邽�߁C�]�v�Ȃ��̂̊����đ���f�[�^�Ɉ����e�����łĂ��܂��܂��D�܂�MAD�@�������x���K�v��SAD�@�Ȃ̂ɒ��g�����g���ƃf�[�^���x�������Ȃ��Ă��܂��Ƃ����W�����}�Ɋׂ��Ă��܂��܂��D����ȗ��R�ł��܂܂�S-SAD�@�́C�����\�ł���Δ��ɗL�v������ǂ��قƂ�ǎ����s�\�ȁC���ɍ���ȕ��@�ł������̂ł��D
3.
�t���[�}�E���g�c�[��
���������ɍ����S-SAD�@�ł����C���������Ɛg�߂Ɏg������@�ɂȂ����Ƃ�����C�^���p�N���̗��̍\����͂���葁���C�����C�ȒP�ɂł���悤�ɂȂ�C���E���̑����̌����҂���Ԃ͂��ł��D�����ʼn�X�͂ǂ�������S-SAD�@�����g�߂Ɏ����ł��邩���l���܂����D���̌��ʁC�����ɂ��u���v��傫�����肷�邽�߂ɔg���̒���X�����g���܂����C�g���̒���X���ɂ���Đ����鑪��f�[�^�̈����e�����C����̍ۂɈ�H�v���邱�Ƃʼn��Ƃ��������}����Ƃ����������s���܂����D���̑���̍ۂ̈�H�v�Ƃ����̂����̏͂ŏЉ��^���p�N�������̃t���[�}�E���g�@�ł��D
�t���[�}�E���g�@���������O�Ƀ^���p�N���̌����͔��Ɋ����Ɏア�Ƃ������Ƃ�m���Ă����K�v������܂��D���̂��߁C�^���p�N�������͉��̂悤�ȓƓ��̕��@�Ő͏o�����C�t�́i�o�b�t�@�[�j�̒��ŕۑ��₻�̑����܂��܂ȑ�����s���܂��D

���̂悤�ȃ^���p�N��������X�����Ǝ˂���ۂɂ́C�������o�b�t�@�[���ƃi�C�������̃��[�v�ɂ������������Ԃł܂邲�Ɓ|180��C�̋C���œ��点�܂��D

���̕��@�͑��삪�ȒP�ȏ�Ɍ����ւ̃_���[�W���y������邽�ߔ��ɉ���I�ȕ��@�ł��D�Ƃ��낪�O�ɏq�ׂ��悤�ɔg���̒���X���͕����Ƃ̑��ݍ�p���������߁C�g���̒Z��X���ł͖����ł��������ȊO�̃o�b�t�@�[��i�C�������̃��[�v�̉e���������Ȃ��đ���f�[�^�Ɉ��e����^���Ă��܂��܂��D�����Ŏז��Ȃ��̂͂Ȃ�ׂ������ɉz�������Ƃ͂Ȃ��ƍl���C�^���p�N���̌������o�b�t�@�[��[�v�����ŁC�������Ƀ_���[�W��^���Ȃ��悤�ȃ}�E���g���@���l�Ă��܂����D���̕��@�ł͓��点���u�O�Ƀo�b�t�@�[���z���ɂ���Ď�菜���Ă��܂��܂��D���̂��߂ɃK���X�ׂ̍��ǁi�L���s�����[�j�̐�[�Ƀi�C�������̃��[�v��ڒ��������}�̂悤�Ȋ������܂����D���̊��̎g�p���@�͉��̒ʂ�ł��D�܂���[�̃��[�v�Ńo�b�t�@�[���ƌ��������������܂��D�����ē��点���u�O�ɃL���s�����[��ʂ��ăo�b�t�@�[���z���������Ă��܂��܂��D����ƌ����͂��܂��L���s�����[�̐�[�ɋz��������̂ōׂ��t�b�N��ɍ׃s���Z�b�g�ȂǂŃ��[�v����菜���C���������ŕێ����ꂽ��ԂɂȂ�Ƃ����킯�ł��D
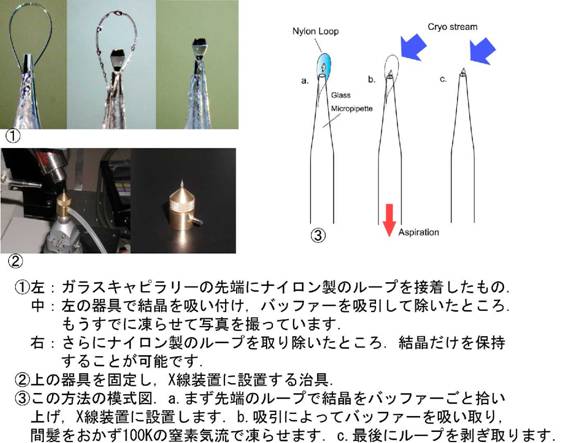
���̕��@�ɂ�葪��f�[�^�̐��x���オ�邱�Ƃ������ɂ��m�F���C���ۂɐV�K�^���p�N���̍\����͂ɐ������܂����D
4.
�\����͗�
����ł͎��ۂɂ��̕��@�ɂ��\����͂ɐ��������^���p�N���������܂��傤�D
�@
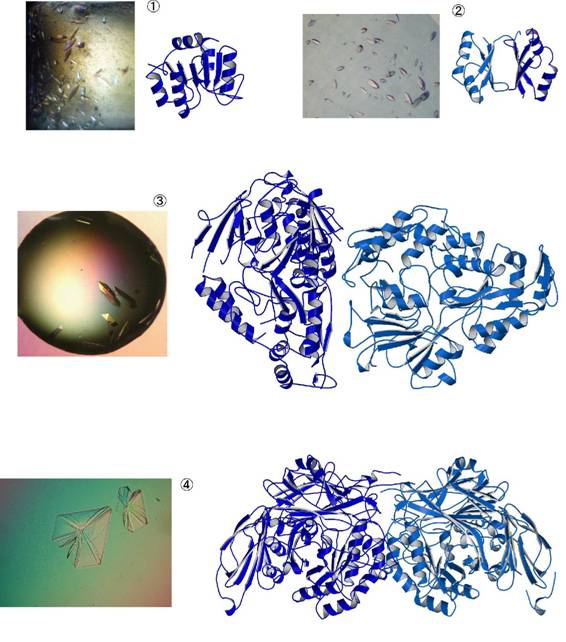
�͂��߂ɁCPyrococcus horikoshii�Ƃ��������x�D�M�ÍۗR����PH1109�Ƃ����@�\���m�^���p�N���ł��D�����ŏЉ�����@�ʼn�͂ɐ��������L�O���ׂ���ꍆ�ł��D�����͗��̂̕H�`�����Ă��܂����D�i144a.a, 16,7kDa�j
�A
���ɓ���Pyrococcus horikoshii�R����PHS023�̂������ɏ����ȃ^���p�N���ł��D�����̓��O�r�[�{�[���̂悤�Ȍ`�����Ă���C��͂̌��ʁC2�̃^���p�N�����q���ő��݂��Ă��邱�Ƃ��킩��܂����D(83a.a, 9.7kDa�~2)
�B
�����Thermus thermophilus�Ƃ������x���M�ۗR����TT0570�Ƃ����^���p�N���ł��D���܂ł�2�ɔ�ׂĂ��Ȃ�傫���C�^���p�N���S�̂ɑ��ė��������Ȃ��������߉�͍͂�����܂����D(603a.a, 68.6kDa�~2)
�C
�����Ă��̒��ł͍ő�̑傫�����������������y�f�ł��D�����͊^�̐������̂悤�ȓƓ��̌`�����Ă��܂����D(738a.a, 84.3kDa�~2)
���݂܂łɃt���[�}�E���g��S-SAD�@�̑g�ݍ��킹���g���Ĉȏ�4�̃^���p�N���̍\����͂ɐ������C����ɑ����̃^���p�N���ɂ��ēK�p��\�肵�Ă��܂��D
5.
�܂Ƃ�
��̑O�Ȃ���悻�����I�Ƃ͎v���Ȃ�����S-SAD�@�ɂ��X�������\����͂ł����C�����ŏЉ�����g��X�����g��������ƌ����̃t���[�}�E���g�ɂ���Č����I�Ȏ�����@�Ɠ��X�ƌ����鎟���ɂ܂łȂ�܂����D����ɂ���Ď����̎�Ԃ��啝�ɒZ�k�ł��邾���ł͂Ȃ��C���ς������Ă��Ȃ��V�R�^�^���p�N�����̂��̂̍\����͂��s�����Ƃ��ł���Ƃ����w�p�I�ɔ��ɗL�Ӌ`�ȕ��@�������̂��̂ƂȂ�܂��D���ɍ\����͂ɂ����鎞�ԁC���s����C�����Ă�����啝�ɐߖ�ł���̂͌����҂ɂƂ��Ĕ��ɖ��͓I�ł��D�Ȃ��Ȃ�Έ�ڂɍ\������͂������^���p�N���͖����ɂ���Ƃ������Ƃł��D���̐��͉��S�C����ɋy�Ԃ��߁D���̃^���p�N���ɂ�����J�͂������ł����炷�H�v�͔��ɗL�Ӌ`�Ȃ��Ƃł��D������̗��R�́C�����̌����҂ɂƂ��ẮC�\����͂͌����̒��Ń^���p�N���̏��邽�߂̈��@�ɉ߂����C���ꎩ�̂��ړI�ł͂Ȃ�����ł��D�m����X�������\����͔͂��ɋ��͂ȕ��@�ł���C��X�ɑ����̗L�v�ȏ��������炵�Ă���܂����C�\����͎��̂������ΏۂƂ��Ă��錤���҂͂��������킯�ł͂���܂���D�命���̌����҂ɂƂ��ẮC�\����͂͂������l�X�Ȏ������瓾��ꂽ���Ȃɂ�������̂��Ƃ�������ɐ�̋c�_�����S�ł��D�ł��̂ł��̕��@�ɂ���č��܂ō\����͂ɂ������Ă��������̎��ԂƘJ�͂����̂ق��̌����₻�̌�̋c�_�Ɏg�����Ƃ��ł��邽�ߔ��ɖ��͓I�Ȃ̂ł��D
���̂悤�ɔ��ɗL�v��S-SAD�@�ł����C�t���[�}�E���g�@�ɂ���Č����I�ȕ��@�ɂȂ����Ƃ͌����C�����̌����҂Ɏg���Ă��炤�ɂ͂܂������Ȃ���Ȃ�Ȃ���肪����܂��D�Ⴆ�C������t���[�}�E���g�@���g���Ă��C�����̎���������x�ȏ�ǂ����̂łȂ��Ɖ�͂��邱�Ƃ͂ł��܂���D�܂������ŏЉ���t���[�}�E���g���s�����߂̃c�[���͑S�Ď���ł���C�܂��s�̂ɂ͎����Ă��Ȃ����ߎ����Ă݂��������҂͑S�Ď��肷�邵������܂���D��X�͌��݁C���̃X�e�b�v�Ƃ��Ă����̖��̉����Ɏ��g�ݎn�߂Ă���C�t���[�}�E���g�@�Ɣėp���Ǝ�������ڎw���Ă��܂��D
�����҂̕��X��
�@���������ł̓l�C�e�B�u��Ԃō\����͂��s���^���p�N���T���v����T���Ă��܂��D�����̂�����͐��A���������D���ɁC���̂悤�ȃ^���p�N����T���Ă��܂��D
�@�@�E���q�ʂ̑傫���^���p�N��
�@�@�E�����ܗʂ̏��Ȃ��^���p�N��
�@�@�E�Z�������C�d���q�u���̍���ȃ^���p�N��
�@�@�E�n�}�ܗʂ̏��Ȃ��^���p�N��
�@�@�E�������˂͏o�邪���܂蕪��\�̏o�Ȃ��^���p�N���i2Å�㔼�`3Å�j
�@���݂܂łɂ����������Ƃ̋��������ŐV�K�^���p�N���̍\����͂ɐ������Ă��܂��D
�A����
�@���u���������@�n糁@�M�v�@�@nobuhisa@sci.hokudai.ac.jp
http://castor.sci.hokudai.ac.jp/~watanabe
�w���@�@�k���@�I�@�@�@kitago@castor.sci.hokudai.ac.jp