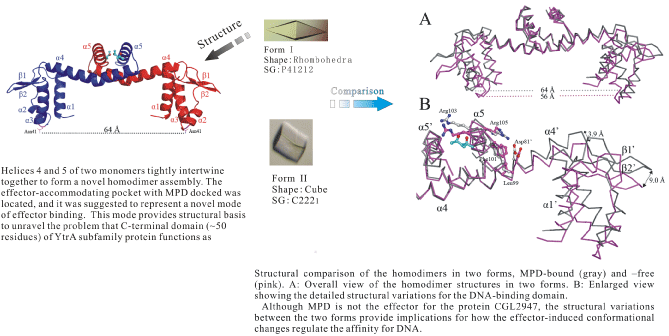

GntRファミリーは,FadR,HutC,MocR,YtrA,AraR,PlmAなどのsubfamilyからなり, 生体内のさまざまな機構の転写調節を行っている.このファミリーのタンパク質はN末 端側にDNA結合ドメインをもち,C末端側にリガンド結合/2量体化ドメインをもつ.なか でもYtrA subfamilyは,他のsubfamilyのタンパク質に比べて,アミノ酸残基数が少なく, C末端ドメインはおよそ50アミノ酸残基しかない.このため,リガンド結合/2量体化ド メインの立体構造や機構は不明であった.グルタミン生産菌C. glutamicum由来の転写 因子CGL2947の立体構造を決定し,YtrA subfamilyに属するタンパク質としては,はじめ て結晶構造を決定した.N末端側にWinged helix-turn-helix (HTH) モチーフで構成さ れたDNA結合ドメインをもち,C末端のリガンド結合/2量体化ドメインは,釣り針のよう な形をしていた.単量体のそれぞれのC末端の釣り針はお互いに引っ掛けあって2量体を 形成する.この2量体化によってリガンド結合ポケットが形成され,そのポケットには 2-methyl-2,4-pentanedil (MPD)が観察された.MPD結合型と非結合型の構造が得られ, YtrA subfamily転写因子におけるDNA結合能を調整するための,リガンド誘導型構造変 化の可能性が示唆された.
Reference