Hansenula saturnus由来
1-アミノシクロプロパン-1-カルボン酸(ACC)デアミネース
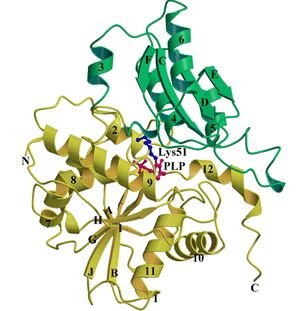
Hansenula saturnus由来ACCデアミネースは342アミノ酸残基,
分子量約37kDaのタンパク質で,一分子あたり一つのPLPがLys51残基
と結合している.X線結晶構造解析では,水銀化合物との共結晶を作
製し多波長異常分散法による位相決定を行った.
異なった晶系の共結晶間でのアベレージングの電子密度改良を行
うことで,良質な電子密度マップを得た.最終的に2.0Å分解能での
構造を決定した.ACCデアミネースは結晶中で二量体で存在している.
単量体は、大小二つのサブユニットに分かれ、それぞれがトリプト
ファンシンテターゼのβサブユニットに似たオープンツイストα-
βバレルを形成している。しかし、他のPLP酵素のβファミリーに
属する酵素とは異なり、ACCデアミネースのPLPは分子内深くに存在
していた。この構造はシクロプロパン開環反応の活性中心を初めて
明らかにしたものである。活性部位周辺の構造から、次のような反
応機構が推定された。
1.PLPと結合しているLys51がACCと結合
2.Lys51によるPro-S炭素への求核攻撃によってACCが開環
3.基質近くに存在するSer78がPro-Rエチレン基からプロトンを引き抜く
4.再びLys51とPLPが結合(α-ケト酪酸とアンモニアの生成
|
Figure Caption
Ribbon diagram of the yACCD monomer consisting of two domains.
Green represents the small domain (residues 58-169) and yellow
represents the PLP-binding domain (residues 1 to 57 and 170 to
341). Both domains fold as an open twisted α/β structure
consisting of a central β-sheet and surrounding helices. The PLP
molecule (red) and Lys51 (blue) are shown as balls-and-sticks.
References
- Crystal structure of
1-aminocyclopropane-1-carboxylate deaminase from Hansenula
saturnus
Min Yao, Toyoyuki Ose, Hiroshi Sugimoto, Atsushi
Horiuchi, Atsushi Nakagawa, Soichi Wakatsuki, Daisuke
Yokoi, Toyotaka Murakami, Mamoru Honma, and Isao Tanaka
|
J. Biol. Chem. 275, 34557-34565 (2000)
|

|

